向固氮酶学习:铁硫凝胶催化剂或开辟由氮制氨的绿色方法
更新日期:2016-05-20目前以大气中氮气(N2)为原料合成氨(NH3)的方法主要有两个,一个是自然界的固氮菌的固氮酶(nitrogenase)过程,一个是有着百年历史的哈伯法(Haber-Bösch process)。固氮酶比较“娇贵”,提取和保持其稳定都不容易,很难用于工业大规模生产;哈伯法需要高温和高压,耗能大排放多。近来也有利用纳米材料和固氮酶配合进行光能固氮的研究(Science, 2016, 352, 448-450, DOI: 10.1126/science.aaf209),也处于实验室的摸索阶段,固氮酶的提取和稳定性也还是问题。
最近,美国西北大学的Mercouri G. Kanatzidis和George C. Schatz等人在《PNAS》上报道了一种绿色的化学固氮方法,有希望在将来代替哈伯法。他们向固氮酶(示意图如下图A)学习,利用酶中拆开氮氮三键的铁-硫团簇(Fe4S4)结构单元,设计了一种光驱动催化剂(示意图如下图B),能够在常温常压下在水中将氮气转化成氨。(Nitrogenase-mimic iron-containing chalcogels for photochemical reduction of dinitrogen to ammonia. Proc. Natl. Acad. Sci. USA, 2016, DOI: 10.1073/pnas.1605512113)
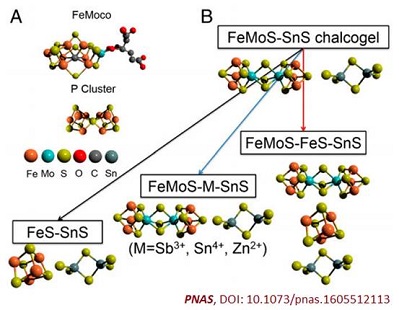
研究人员先合成了Fe4S4团簇,随后与[Sn2S6]4-阴离子相连,形成泡沫状硫属凝胶(chalcogel)。这种黑色材料吸收可见光,并使用光能来打开化学上最强的键之一——氮气的氮氮三键,氮原子随后与来源于水的氢结合生成氨。

FeMoS-FeS-SnS硫属凝胶的示意图(a)、照片(b)、SEM图像(c)和TEM图像(d)
与之前的工作所报道的Fe-Mo-S无机团簇相比(J. Am. Chem. Soc., 2015, 137, 2030-2034),Kanatzidis等人惊讶的发现,这次工作设计的不含Mo元素的Fe-S团簇具有更高的氮气还原活性(下图C),也就是说在这种催化剂中Mo元素可能并不是氮气还原所必须的。
相关阅读:ACS《化学化工新闻》周刊报道(英文)
(摘自 X-MOL化学平台)