Science报道余金权团队碳氢键活化研究新成果
更新日期:2016-09-30“碳氢键活化是有机化学中的圣杯”,这句被多位大牛提及的名言,足以说明碳氢键活化在有机化学中的重要性和独特地位。碳氢键活化的难点在于活性和选择性,几乎所有碳氢键活化的新进展都围绕着如何解决活性和选择性的问题。亚甲基(CH2)是有机化合物中最常见的基团之一,不过活化其中的碳氢键并将其转化为手性中心,对化学家来说依然还是个巨大的挑战。
近期,美国斯克里普斯研究所(The Scripps Research Institute,TSRI)的华人化学家余金权(Jin-Quan Yu)教授携手加州大学洛杉矶分校(UCLA)的K. N. Houk教授在Science上发表文章,实现配体促进的亚甲基sp3碳氢键不对称活化。在这篇论文里,化学家们通过使用乙酰基保护的胺乙基喹啉配体,实现了单一亚甲基碳中心上前手性碳氢键的不对称钯插入,他们还把这些钯复合物用于了脂肪族酰胺的β-位碳氢键不对称官能团化,使用双齿配体来加速碳氢键的活化对于避免底物诱导的环钯化背景反应是至关重要的,从而可以保证高的对映选择性。作者还将这一配体促进的碳氢键活化反应用于了简单羧酸底物的β-位碳氢键芳基化,而不需要再引入导向基。(Ligand-accelerated enantioselective methylene C(sp3)–H bond activation. Science, 2016, 353, 1023-1027, DOI: 10.1126/science.aaf4434)
如图1A所示,传统的用于选择性地活化两个前手性的碳中心上碳氢键的方法主要是在手性配体的作用下,进行选择性的钯插入实现去对称化的。而对于β-位带有芳基的羧酸类、酰胺类的化合物有两种合成方法,一是铑催化的不对称1,4-加成,一是钯催化的β-位碳氢键活化(图1B)。本文的工作如图1C所示,采用新开发的乙酰基保护的胺乙基喹啉配体即APAQ 配体(acetylprotected aminoethyl quinoline),促进了对于羰基的β-位前手性亚甲基上碳氢键不对称官能团化。
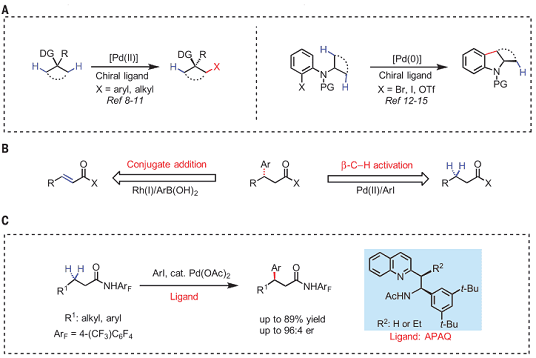
图1. 对映选择性亚甲基C-H活化反应,图来源:Science
首先,作者对配体进行了筛选,包括各种非手性的不同碳链长度的乙酰胺基取代的烷基喹啉衍生物以及带有芳基的手性的乙酰胺基取代的烷基喹啉衍生物,发现配体35给出了最佳的结果,产率82%,选择性92.5:7.5。并通过和计算大牛Houk课题组的合作,分别给出了R构型和S构型产物的过渡态的相对自由能,在过渡态中,双齿配体上的喹啉氮和乙酰胺基上的氮以及底物中的酰胺氮同时和钯络合,在活化亚甲基上碳氢键的同时诱导了手性的产生。可以看出,选用L35,产生R构型的产物从能量上来说还是比较有利的。
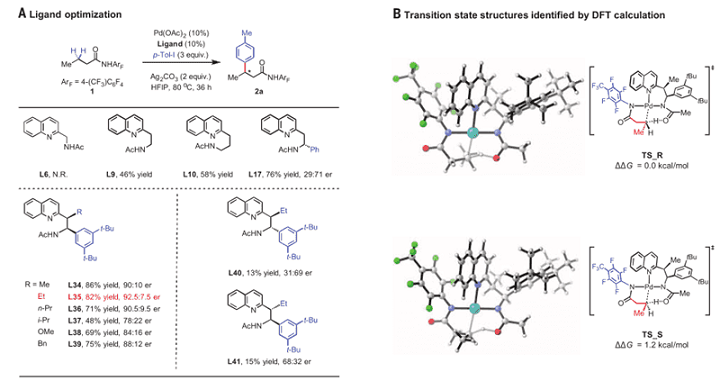
图2. 配体的筛选及过渡态自由能比较,图来源:Science
选好了配体,有了最佳反应条件,接下来就是对底物的扩展,选用胺基上氟代苯取代的丁酰胺做底物,对于芳基碘代物进行筛选,可以看出,芳基碘上还可以带有卤素、羰基、酯基、三氟甲基、烷基、烷氧基等,二十几个底物都取得了良好的收率和非常优秀的选择性,对于一些复杂体系如芳基碘代物2s及2v也都能顺利发生反应,产物还可以进一步的官能团化,用于有机合成。
除了对碘代物进行扩展以外,作者还对酰胺类底物进行了扩展,底物中的R可以是是各种一级烷基、二级烷基或者环烷基,甚至可以带有哌啶,带有四氢吡喃环等,当然也可以是苯基或者取代的苯基,都取得了优良的结果。当R基上带有酮羰基(4p)或者R为哌啶(4r)时,产率降低。更值得一提的是,作者还把这一方法用于了两个带有小环的羧酸类底物。
总结:
该团队通过使用双齿的乙酰基保护的胺乙基喹啉配体APAQ,实现了单一亚甲基碳中心上前手性碳氢键的不对称钯插入,进而实现亚甲基上sp3碳氢键的不对称芳基化,这为发展更为广泛的有用的不对称碳氢键活化反应开辟了一条新的道路。
(来源:X-MOL)