福建物构所逆转肿瘤细胞多药耐药研究获进展
更新日期:2023-04-26P-糖蛋白(P-gp/ABCB1)是一类典型的多药耐药转运蛋白,可以识别和促进肿瘤细胞的药物外排,严重限制了药物的疗效。我们先前发现磷脂酰肌醇-3-激酶(PI3K)的110α和110β亚单位是抑制P-gp介导的肿瘤多药耐药的新靶点;BAY-1082439作为PI3K 110α和110β亚单位的特异性抑制剂,通过下调P-gp的表达可逆转P-gp介导的肿瘤多药耐药。然而,BAY-1082439存在水溶性差、半衰期短、在体内的清除率高等不足。迄今为止,具有靶向PI3K P110α和P110β以及抑制P-gp介导的肿瘤多药耐药的纳米药物系统尚未见报道。
近日,在国家自然科学基金、福建省创新人才项目、福建省自然科学基金等项目资助下,中国科学院海西研究院陈卓课题组发明了一种具有肿瘤靶向性的多功能纳米体系PBDF,该体系包括具有良好生物相容性的PLGA-SH及其包裹的阿霉素(DOX)和BAY-1082439颗粒。这些纳米颗粒枝接到叶酸修饰的金纳米棒(Au-NRs)上,利用叶酸介导靶向肿瘤作用,增强了PBDF抑制P-gp介导的肿瘤多药耐药。与未经包裹的DOX联合BAY-1082439治疗组相比,PBDF显著增加肿瘤细胞KB-C2(过表达P-糖蛋白)对药物的摄取,并诱导滞留于细胞发生S期阻滞和细胞凋亡,有效抑制了肿瘤细胞的增殖和转移,从而达到克服肿瘤细胞的多药耐药性。相关成果以“A multi-functional nano-system combining PI3K-110α/β inhibitor overcomes P-glycoprotein mediated MDR and improves anti-cancer efficiency”为题,发表于Cancer Letters (https://doi.org/10.1016/j.canlet.2023.216181)。中科院福建物构所与福建农林大学联合培养硕士研究生林瑞坤为本文第一作者,陈卓研究员和张蕾研究员为共同通讯作者。
近年来,团队在克服肿瘤多药耐药性的药物研发方面取得了一系列重要进展,包括通过CRISPR/Cas9基因敲除和转录组学证明了PI3K 110α、110β 可作为抑制P-gp介导的肿瘤多药耐药的靶点(Molecular Cancer 2020, 19: 10)、PI3K-CDK6是抑制P-gp介导的肿瘤多药耐药的靶向信号轴,其特异性缺失可逆转肿瘤多药耐药(Molecular Cancer 2022, 21: 103;Acta Pharmaceutica Sinica B 2023, 13: 982-997)。此外,团队发现细胞周期蛋白依赖性激酶 (CDK) 抑制剂Ribociclib/LEE011通过CDK6缺失而下调P-gp表达,进而抑制P-gp介导的肿瘤耐药性(Frontiers in Pharmacology 2022, 13: 867128)。这些研究成果为攻克肿瘤多药耐药性提供了重要靶点和新的治疗途径。
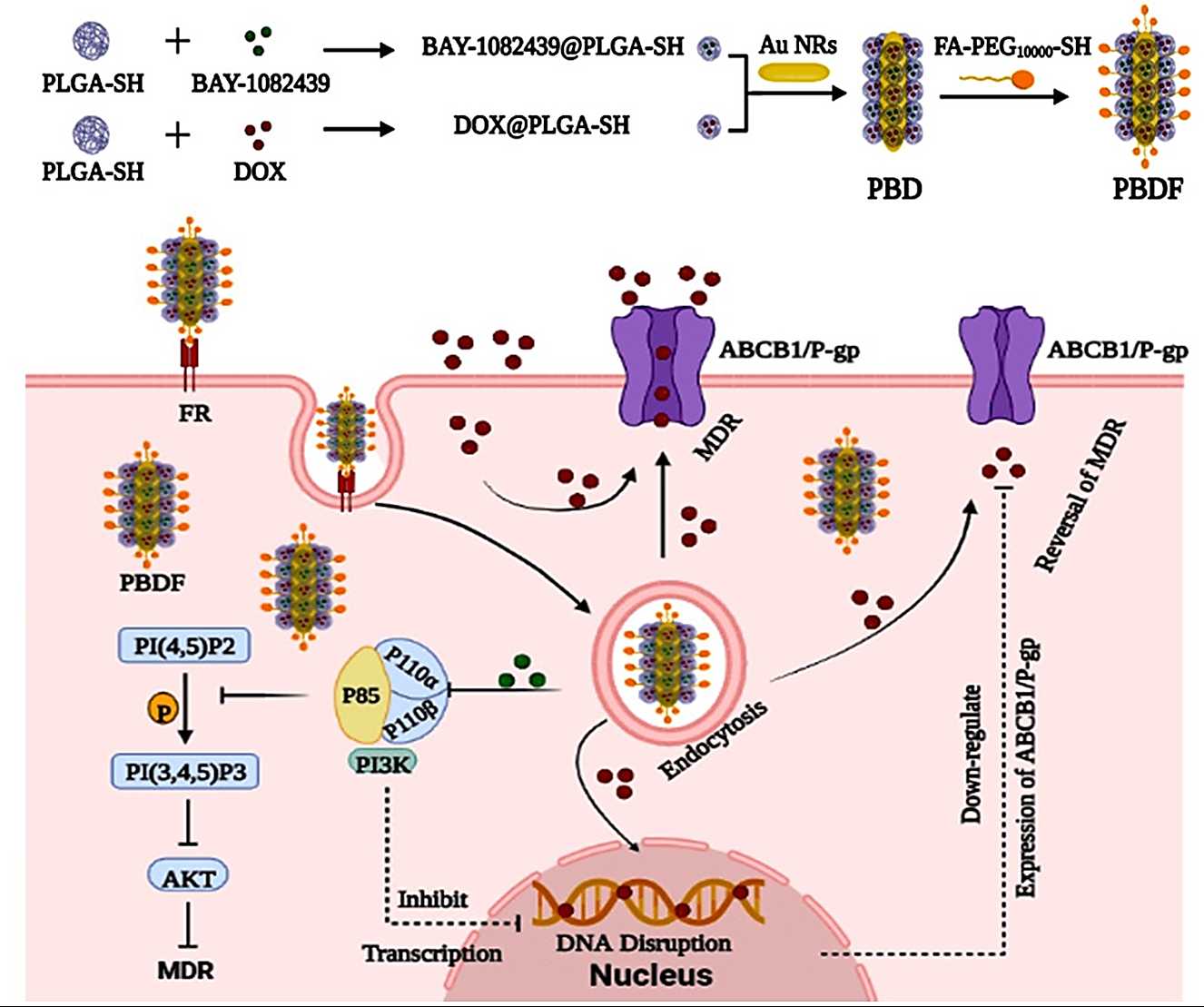
图1 多功能纳米体系PBDF的构建及其提高抗肿瘤作用机制示意图。PBDF通过下调肿瘤细胞中多药耐药转运蛋白——P-糖蛋白(P-gp/ABCB1)的表达,促进抗肿瘤药物在肿瘤细胞中的摄取,从而提高抗肿瘤活性。
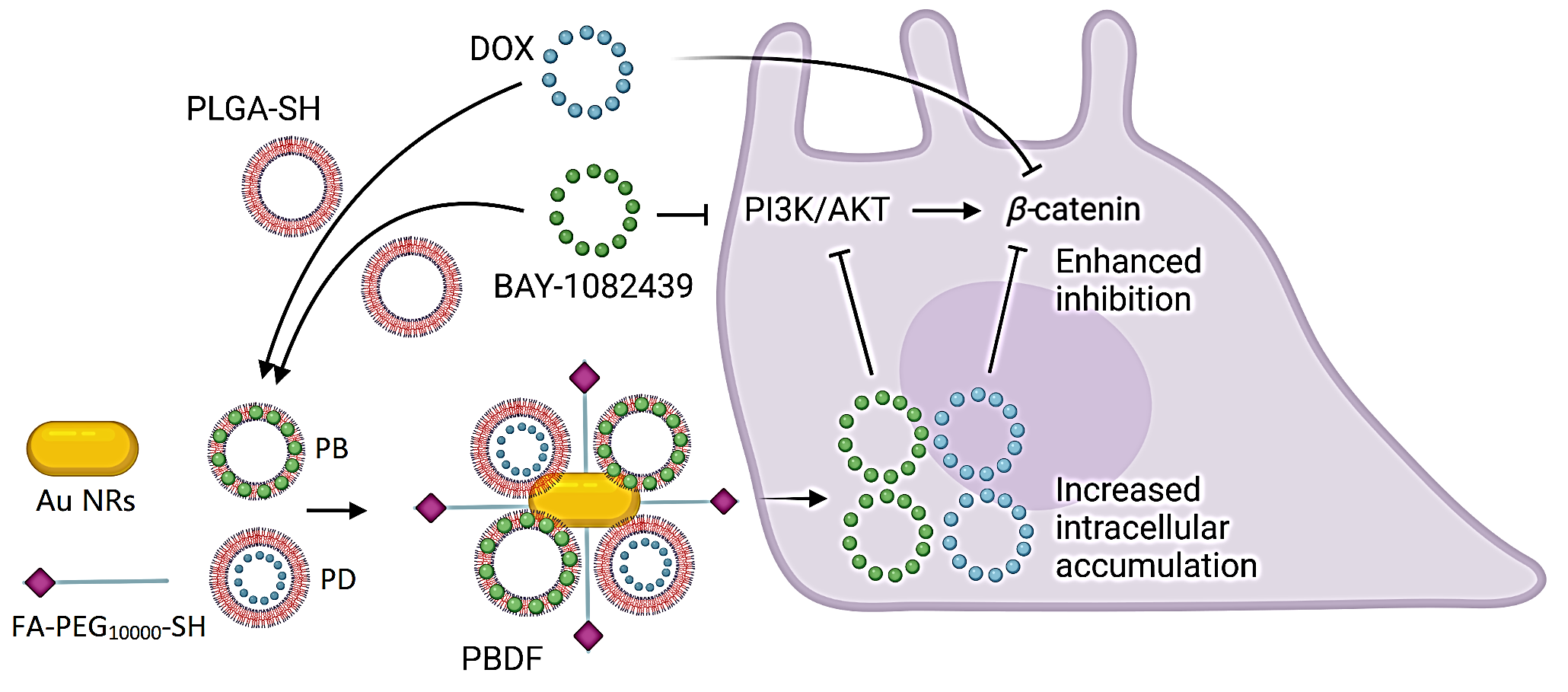
图2 多功能纳米体系PBDF负载协同化疗药物(阿霉素DOX、BAY-1082439)下调β-catenin表达,从而抑制肿瘤细胞迁移的机制示意图。
论文信息:
标题:A multi-functional nano-system combining PI3K-110α/β inhibitor overcomes P-glycoprotein mediated MDR and improves anti-cancer efficiency
作者:Ruikun Lin, Lei Zhang*, Biwei Ye, Yanan Wang, Yi-Dong Li, Jason Hsu, Wenzhen Liu, Ping Hu, Jincan Chen, Zhe-Sheng Chen, Zhuo Chen*
期刊:Cancer Letters 2023, DOI: 10.1016/j.canlet.2023.216181
论文链接:https://doi.org/10.1016/j.canlet.2023.216181
(陈卓课题组供稿)