福建物构所双靶点纳米抗体研究取得新进展
更新日期:2025-04-22近日,在国家自然科学基金、福建省自然科学基金重点项目以及中国科学院福建物质结构研究所(以下简称:福建物构所)“前瞻跨越”计划揭榜挂帅项目等多项科研项目支持下,福建物构所陈卓课题组在双特异性纳米抗体研发中取得重要突破,为攻克肿瘤耐药性和转移难题提供了创新解决方案。相关研究成果以“Transient intracellular expression of PD-L1 and VEGFR2 bispecific nanobody in cancer cells inspires long-term T cell activation and infiltration to combat tumor and inhibit cancer metastasis”为题,发表于Molecular Cancer(DOI: 10.1186/s12943-025-02253-6)。福建物构所陈卓研究员、张蕾研究员及中山大学附属第一医院柯尊富教授为共同通讯作者。张蕾研究员与福建农林大学-中国科学院福建物质结构研究所联合培养硕士生林云凤为共同第一作者。
研究团队创新性设计出可同时靶向PD-L1和VEGFR2的双特异性纳米抗体FAP1V2。该抗体通过基因工程改造,仅保留抗体重链可变区(VH),形成仅约15kDa的纳米级结构,较传统单抗(150kDa)体积缩小10倍,展现出三大显著优势:1)深度渗透:纳米尺寸使其更易穿透肿瘤致密间质,直达病灶核心;2)双重阻断:同步抑制PD-L1/PD-1免疫检查点信号和VEGFR2介导的肿瘤血管生成及转移通路;3)低免疫原性:经优化的蛋白结构显著减少人体免疫系统识别风险。在小鼠乳腺癌模型中,FAP1V2展现出显著的协同干预效能。实验数据显示,经FAP1V2处理的小鼠原发肿瘤体积较对照组缩小68%,肺、肝转移灶数量锐减82%,肿瘤微环境中效应T细胞(TCR βhi/CD25hi亚群)浸润密度提升4.3倍。值得注意的是,部分实验小鼠在二次接种同种肿瘤细胞后,免疫系统展现出强大的记忆效应,成功实现肿瘤完全排斥。
分子机制研究揭示,FAP1V2通过精准调控肿瘤信号网络发挥治疗作用。转录组分析表明,该抗体显著抑制Wnt/β-catenin经典通路,阻断肿瘤干细胞自我更新能力;同时靶向MET-PI3K信号轴,削弱肿瘤细胞的侵袭迁移潜能。双重通路抑制协同下调肿瘤干细胞标志物CD44表达,显著削弱肿瘤转移的种子细胞库。这项研究不仅验证了双靶点纳米抗体的技术可行性,更揭示了其重塑肿瘤微环境的独特优势。FAP1V2如同“分子剪刀”,精准剪断肿瘤逃逸的双重保险——免疫抑制和转移信号,为开发新一代免疫联合疗法提供了核心元件。目前,团队正基于FAP1V2开发靶向递送系统,探索其与CAR-T细胞疗法、溶瘤病毒等技术的联用潜力。未来将联合多种前沿肿瘤治疗手段,推动个性化癌症治疗方案的优化。
该研究团队长期专注于癌症发生机制及免疫治疗领域的研究探索,近年来在相关学术领域取得了丰硕成果,其研究成果相继发表于国际知名学术期刊,包括Molecular Cancer (2020,19:10;2022,21: 103)、Acta Pharmaceutica Sinica B (2023,13: 982) 以及Cancer Letters (2023,563: 216181)等刊物上发表了一系列具有重要影响力的研究论文。
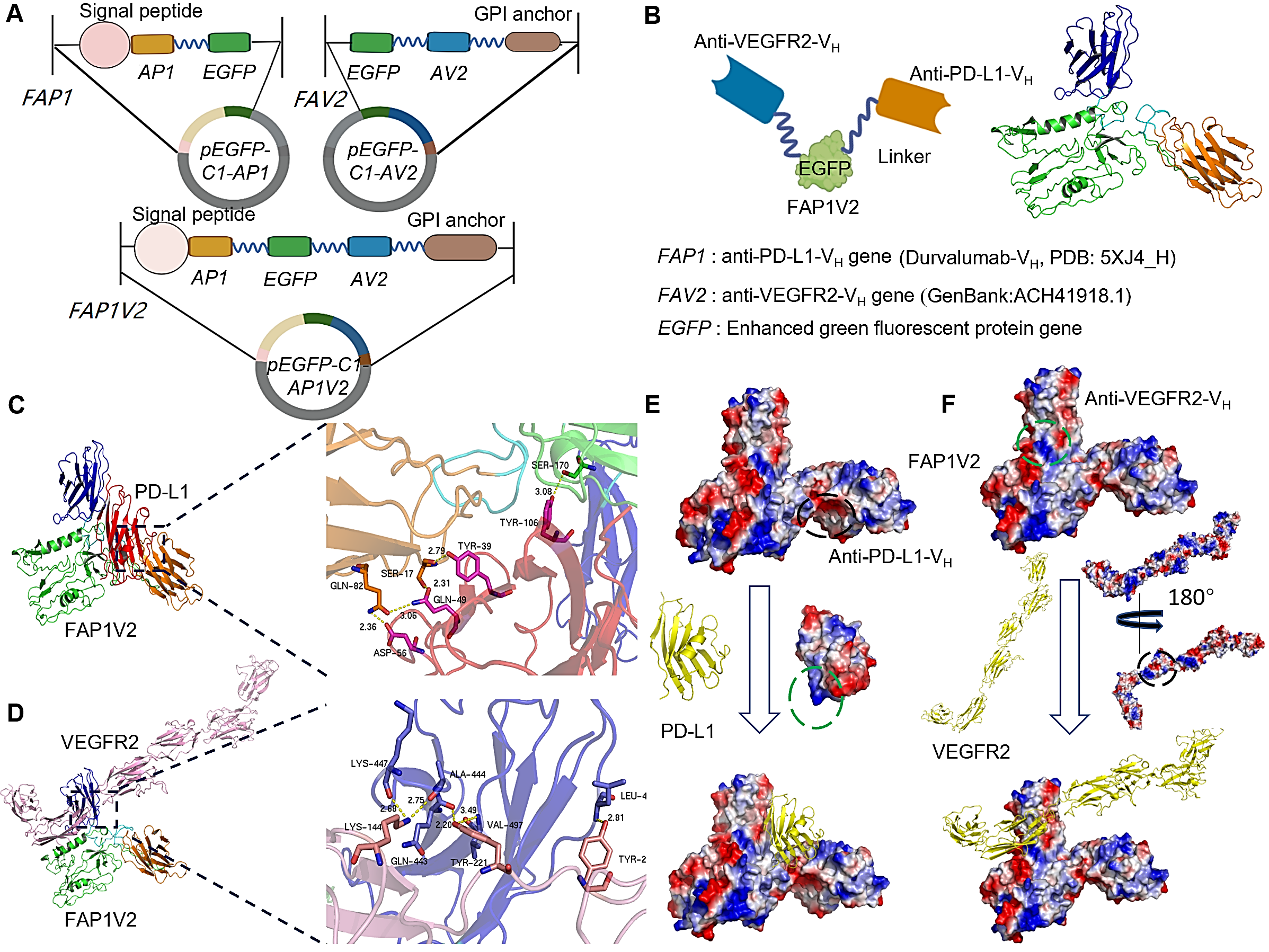
图1.复合物FAP1V2/PD-L1及FAP1V2/VEGFR2的胞内抗体设计及分子对接。(A)重组双特异性胞内抗体基因(FAP1V2)序列包含IL-2信号肽、抗PD-L1 VH基因(AP1)和抗VEGFR2 VH基因(AV2)、EGFP报告基因以及GPI锚定序列。pEGFP-C1-AP1携带FAP1,pEGFP-C1-AV2携带FAV2。(B)FAP1V2的三维模型。橙色区域表示抗PD-L1 VH(AP1);深蓝色区域表示抗VEGFR2 VH(AV2);绿色区域表示EGFP,其通过(GGGGS)₃连接子(以浅蓝色显示)分别与抗PD-L1 VH和抗VEGFR2 VH融合。(C)和(D)分别为FAP1V2与PD-L1(红色)和VEGFR2-ECD(粉色)的分子对接及结合位点预测。(E)FAP1V2与PD-L1间接触电位。(F)FAP1V2与VEGFR2间接触电位。正电荷区域用黑色圆圈标出,负电荷区域用绿色圆圈标出。静电表面图中,蓝色和红色分别代表中性pH条件下所呈现的正静电电位和负静电电位。
(陈卓课题组供稿)